FISTULA ESOFAGICA EN OVINOS: TECNICA QUIRURGICA y CUIDADOS PRE y POST OPERATORIOS
Pueyo, J.M., Robles, C.A. y Olaechea, F.V. - Grupo de Salud Animal- INTA. CC. 277 (8400) Bariloche, Argentina –
RESUMEN
Con el fin de ser utilizados en la determinación de la composición botánica y el valor nutritivo de la dieta de ovinos en pastizales naturales, y además poder determinar el grado de contaminación de los pastos por larvas de parásitos, se realizaron fístulas esofágicas en 12 capones Merino.
Con el animal en decúbito lateral derecho, previa aplicación de un tranquilizante, se infiltro localmente con una solución anestésica y se reaoli zuna incisión en piel de 5 cdme longitud en la cara lateral izquierda del cuello, tercio medio hacia ventral. Por divulsión se abordó el esófago y tras su incisión, se fijaron sus bordes a la piel mediante la aplicación de 10 puntos con catgut 000.
La cánula utilizada se compone de dos piezas silmares opuestas, realizada en acrílico de uso odontológico. Como resultado, se obtuvo un 50% de animales aptos para el muestreo. Se considera que la técnica descripta es adecuada, ya que con esta y un eficiente cuidado post operatorio pra lograr una buena cicatrización, se logró un porcentaje de éxito superior a trabajos iguales.
INTRODUCCION
En 1855 Claude Bernard trabajó sobre fístulas esofágicas en caballos. En 1929, Sairit apunta las razones por las cuales la intervención quirúrgica del esófago es una tarea delicada de realizar, y recién en 1939 se realizan las primeras fístulas esofágicas en rumiantes, llevadas a cabo por Goldman, quien trabajó con bovinos. (Van Dyne y Torrel, 1964).
En 1954, Torrel comienza a trabajar con ovejas fistuladas, dando a conocer la técnica quirúrgica y cuidados pre y post operatorios, con los cuales tuvo éxito en una de cada cuatro ovejas fistuladas, ya que las pérdidas de saliva por el esófago no podían ser controladas (Van Dyne y Torrel, 1964).
Mc Manus (1962) introduce una técnica para taponamiento de fístulas con tapones de goma látex, controlándose las pérdidas de saliva en la mayoría de los casos, pero no siempre mantenía la misma medida de fístula durante los días siguientes a la operación, ya que por la extrema labilidad del tejido, podía crecer hasta cerrarse o aumentar de diámetro.
Luego introdujo los tapones divididos, los cuales tuvieron la ventaja de ser de fácil colocación y extracción. Mc Manus, Arnold y Hamilton (1962) obtuvieron tasas de efectividad del 29% y 34%, a diferencia de la obtenida anteriormente por Mc Manus (1962), que fue del 15%. Consideran que la diferencia se debió a un extenso post operatorio que permitió una buena cicatrización de la fístula.
En 1979, se llevaron a cabo en la EERA Bariloche 13 operaciones de fístulas esofágicas en ovinos, obteniéndose una utilización del 15%. Los principales problemas se debieron a graves disturbios digestivos. Es de considerar que estos animales no tuvieron un post operatorio adecuado.
La mayoría de los autores son coincidentes en que las pérdidas de saliva representan el mayor de los problemas y ser1a la causante de disfunciones digestivas. La manera por la cual actuaría el déficit de saliva en el rumen en dicho problema digestivo, habría que deducirla de la función que cumple la misma y que entre otras, según Church (1974) serían:
a) Mantener el pH del rumen.
b) Actuar como tampón.
c) Aportar nutrientes para los microorganismos del rumen.
d) Poseer propiedades antiespumantes.
Diversos autores, han demostrado que una dieta deficiente en sodio ejerce un efecto notable en el contenido de sodio y potasio de la saliva producida por la parótida. Se demostró que una fístula salival es un procedimiento sencillo para producir una deficiencia de sodio, si la saliva segregada no retorna al aparato digestivo. Al no realizarse la reposición se agotaba el sodio animal; disminuía la cantidad de saliva desde 3 a 1 litro por día y la concentración de sodio bajaba desde 180 a 60 mg/l.
Es de suma importancia toda información relacionada con la calidad y cantidad de alimentos consumidos por animales en pastoreo. Para ello se han utilizado animales con fístula esofágica, las cuales pueden ser usadas para el muestreo del material ingerido, y así medir más acertadamente las tomas de pasturas, para la identificación de la selección de plantas, y además ser de valor para el asesoramiento sobre grado de contaminación de los pastos por larvas de parásitos.
Según los autores citados anteriormente, el uso de los animales fistulados para estos fines, depende del éxito que se tenga en la intervención quirúrgica, en un buen post operatorio y en el tiempo transcurrido entre la operación y la utilización del animal en el muestreo. Es por ello que en el desarrollo de esta comunicación se explica la técnica quirúrgica y los problemas que se presentaron en el post operatorio.
MATERIALES y METODOS
Se seleccionaron 12 capones de dos dientes de la raza Merino, vacunados contra mancha, gangrena y enterotoxemia (a). Días antes de la operación se los mantuvo en corrales bajo techo con piso de cemento, alimentados con pellets de alfalfa. Se colocaron entre 3 y 4 animales por corral, los a lab. Mardubo cuales eran de una superficie de 9 m2.
Pre operatorio:
Se procedió a colocar los animales en ayuno de agua y comida 24 hs antes de la operación.
-Se preparó el campo operatorio esquilando y afeitando el área quirúrgica en una superficie aproximada de 20 x 12 cm en la cara lateral izquierda media -ventral de la tabla del cuello.
-Se medicó con Sulfato de Atropina al 6%, 1 ml IM (b).
-Antes de ubicar al animal sobre la mesa operatoria, se procedió a aplicar un tranquilizante (Clorhidrato de Promacina) (c) a la dosis de 2 mg/kgv IM.
Técnica quirúrgica: Se utilizó una modificación de la técnica quirúrgica de Casaro, Cauhepé, Gomez y Chifflet de Verde (1981).
-Los animales fueron mantenidos en decubito lateral derecho.
-Previa desinfección del área quirúrgica con preparado de Iodo Orgánico (d) se procedió a la anestesia local con Novocaína al 2% (e).
-Se realizó una incisión de 5 cm de largo en la piel, debajo del músculo esternocefálico.
-Se divulcionaron los tejidos hasta llegar al esófago (en alguno; casos se utilizo una zonda plástica envaselinada de 17 mm de diámetro, que introducida por vía bucal al esófago, facilita la ubicación de éste).
Se tomó el esófago con pinza atraumática (y retiro de zonda en el caso que se hubiera utilizado) y se procedió a efectuar la disección del mismo de los tejidos adyacentes, en un área de unos 3 cm de largo, permitiendo esto el pasaje de una zonda acanalada por detrás del esófago, fijándolo de esta manera.
-Con bisturí se realizó una incisión longitudinal del esófago, de unos 2,5 cm incluyendo muscular y mucosa.
-Se fijaron los bordes del esófago a la piel mediante la aplicación de 10 puntos separados con Cat gut 000 (f).
-Se aplicó pomada cicatrizante a la herida (g) antes de ser colocada la cánula.
-Se procedió a aplicar la cánula previa untada con vaselina líquida.
Post operatorio: La cánula no fue sacada hasta siete días posteriores a la 1ntervención. Durante esos días la higiene se realizó con líquido antiseptico a presión con jeringa (h).
A partir del séptimo día la herida fue atendida día por medio, mediante desinfección con líquido antiséptico y aplicación de pomada cicatrizante, la zona adyacente a la fístula fue lavada con agua y esponja.
Inmediatamente después de operados los animales tuvieron libre acceso a pellets de alfalfa, harina de hueso en bateas (i) y sal común en la proporción de 2/3 y 1/3 respectivamente.
Estos animales no fueron llevados a campo hasta 45 a 60 días posteriores a la intervención. A partir de este momento las curaciones e higiene de la fístula, sacando la cánula, se realizaron una vez por semana.
Además, en forma individual se les administró saliva, ya que la pérdida de esta podría traer aparejado una deshidratación que según Mc Manus (1962) es una de las mayores dificultades que se presentan.
La saliva artificial preparada por el Laboratorio de Nutrición de la Estación Experimental Bariloche tuvo la siguiente formulación:
Na2 HP0 4= 5,58 g
C03 HNa = 14,7 g
Cloruros= 30 ml
H20 destilada= 1500 ml
La formulación de cloruros fue la siguiente:
KCl = 14,25 g
NaCI = 11,75 g
MgCl2 = 2,74 g
CaCl2 = 1 gr
H2O = 5500 ml
La cantidad administrada fue de acuerdo a la estimación de las pérdidas, considerándose poca pérdida cuando apenas mojaba la lana del cuello, y mucha pérdida cuando la saliva caía hasta el suelo dejando manchas en el mismo (en el primer caso no se le administró saliva).
Cánulas: Se realizó en acrílico de uso odontológico y ortopédico una cánula compuesta de dos piezas similares opuestas, según indica en el modelo descripto (Figura 1).
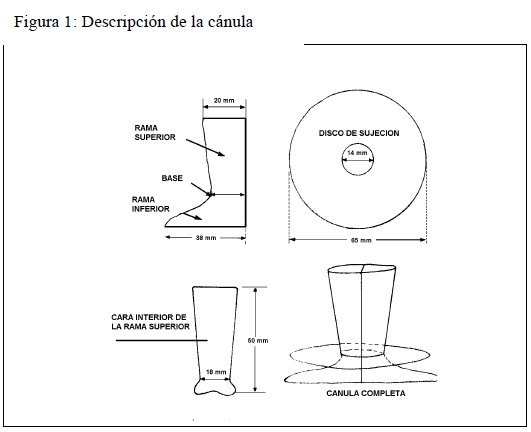
La base es oval con un perímetro de 8 cm, las dos ramas inferiores son de igual longitud. La sujeción se llevó a cabo por medio de un disco de goma muy flexible de 65 mm de diámetro y asegurada en el extremo de las ramas superiores mediante un hilo. Posteriormente se utilizó el mismo tipo de cánula, pero con un perímetro en la base de 9 y 10 cm para aquellos animales a los cuales se les había agrandado el orificio de la fístula.
Los 12 capones intervenidos consignaron los siguientes resultados:
-Uno muerto con hallazgo patológico de hidronefrosis.
-Dos muertos a los 35 y 82 días por deshidratación (por pérdida de cánula).
-Tres vivos, no aptos para muestreo. Uno por estado general deficiente y dos por desprendimiento de la mucosa.
-Seis aptos para muestreo. Esto representa el 50% de efectividad. De este grupo se les dió saliva a los que evidenciaron pérdidas; las cantidades administradas por vez oscilaron entre 750 ml y 2 litros.
Esto ocurrió en un 66% de los animales. Junto con la saliva se les incorporó un estimulante de la flora ruminal (a).
La pérdida de la cánula ocurrió en un 58% de los animales y entre los 15 y 40 días. Las causas de estas pérdidas se atribuyeron, en algunos casos, al agrandamiento del orificio de la cánula de la fístula, pero en otros casos pudo ser debido a que el largo de la rama inferior de la cánula es de poca longitud, lo que quitaría superficie de sostén. Además, se ha observado el desprendimiento; de la cánula por efecto del rascado del miembro posterior en la zona de la fístula.
Uno de ellos tuvo gran pérdida de saliva, incluso en tres oportunidades amaneció sin cánula, debido al gran tamaño de la fístula. A los 26 días se lo vio sin cánula, probablemente estuvo sin ella más de un día (el día anterior no se los había controlado) y el orificio se redujo de tal manera, que una vez colocada la cánula dejo de perder saliva. A los dos días comenzó nuevamente la pérdida pero en pequeña cantidad.
Por lo observado anteriormente, a tres animales se les saco ex profeso la cánula durante un día (a los 19, 20 y 27 días respectivamente) para facilitar la cicatrización y producir una disminución en el diámetro del orificio, con relativo éxito.
CONCLUSIONES
Se concluye que es muy importante el período de cicatrización, ya que de no ser perfecto, trae como consecuencia el desprendimiento de la mucosa, infecciones e incluso variaciones en el tamaño de la fístula. Para que se produzca una buena cicatrización es de suma importancia la Técnica Quirúrgica (la cual se considera adecuada) y una buena higiene durante la intervención como en el post operatorio.
Hay que tener en cuenta el período transcurrido entre la intervención del animal y el primer muestreo, dado que hasta que no se haya producido una buena cicatrización no es conveniente llevar los animales al campo, donde son menos controlados y no se pueden hacer las curas necesarias. Se considera necesario un mínimo de 45 días.
El tipo de cánula cumple una función muy importante, de ahí que se utilicen las de acrílico que son de superficie más suave que las de goma, y más fáciles para ser higienizadas.
Sería conveniente utilizar las que se indican en este trabajo, pero con la porción intraesofágica de mayor longitud, lo que haría más difícil su desprendimiento.
De acuerdo a lo manifestado por distintos autores y a lo que hemos podido comprobar en el transcurso de nuestro trabajo, la saliva parece ser el factor de mayor incidencia en los desequilibrios digestivos que se producen; por lo tanto, hasta que se realice la segunda etapa del trabajo, que contemplará un seguimiento de los niveles de distintos metabolitos en sangre, en especial de Na y K, se continuará administrando saliva y estimulantes de la flora ruminal a los que clínicamente se considere necesario.
AGRADECIMIENTOS
Al Ing.Agr. Oscar Astibia y Dra. Mirta Lewis, por su colaboración en el desarrollo de este trabajo.
BIBLIOGRAFIA
CASARO, A., CAUHEPE, M.A., GOMEZ, P.O. y CHIFFLET DE VERDE, S. 1981. Fístula de esófago en bovinos. Técnica Quirúrgica y cuidados pre y post operatorios.
Producción Animal (Buenos Aires, Argentina) Vol 7: 565-571. CHURCH, D.C. 1974. Factores que influyen en la cantidad o calidad de la saliva. Fisiología digestiva y nutrición de los rumiantes. Ed. Acribia.
Mc MANUS, W.R. 1962. Oesophageal fistulation studies in the sheep. Aust.Vet.J. (3): 85-91.
-----ARNOLD, G.W. y HAMILTON, F.J. 1962. Improved techniques in oesophageal fistulation of sheep.
Aust.Vet.J. 38 (5): 275-282. VAN DYNE, G.M. y TORREL, D.T. 1964. Development and use of the oesophageal fistula. A. review. J.Range Management. Vol 17(1): 7- 19.


